化妆品原料《两代生殖发育毒性试验》的评价(征求意见稿)
两代生殖发育毒性试验
Two-generation reproductive toxicity
(征求意见稿)
范围
本规范规定了两代生殖发育毒性试验基本原则,试验方法和技术要求。
本规范用于检测化妆品原料的生殖发育毒性。
试验目的
提供关于受试物产前、产后暴露对雌性、雄性动物生殖功能、生育力及子代发育影响的确切信息。
定义
3.1 生殖毒性
对后代产生有害作用,并损伤雄性和雌性的生殖功能和生殖能力。
3.2 发育毒性
生殖毒性的表现,具体表现为后代在产前、围产期、产后发生的结构和功能紊乱。
3.3 母体毒性
受试物引起亲代雌性妊娠动物直接或间接的健康损害效应,表现为增重减少、功能异常、毒性反应、甚至死亡。
3.4 未见毒性反应剂量(NOAEL)
通过动物试验,以现有的技术手段和检测指标未观察到任何与受试物相关的毒性作用的最大剂量。
3.5 最低毒性反应剂量(LOAEL)
在规定的条件下,受试物引起实验动物组织形态、功能、生长发育等有害效应的最小作用剂量。
试验的基本原则
通过对实验动物以受试物暴露,考察其对雄性和雌性动物生殖功能、生育力及生殖系统形态的影响。若该暴露(直接或间接)持续至子代,则还可以继续考察受试物对子代发育,甚至子代生殖功能和生育力的影响。
受试物配制
化妆品原料一般采用经口、经皮或吸入方式给予受试物,溶媒对照应采用相同的给予途径。若设置阳性对照,其处理方式可以不同于受试物处理组。
一般情况下首选水作为溶媒,可以是水溶液也可以是混悬液,其次可以选择玉米油作为溶媒配制成乳浊液,也可以将其与水混合配制成油溶液。使用水以外的其它溶媒,应阐明其毒性并保证所配制溶液的稳定性。
其它应纳入考虑的因素包括:溶媒是否影响受试物化学特征继而改变受试物毒性;溶媒是否影响受试物的吸收、代谢、分布和蓄积;溶媒是否影响动物食物和饮水摄入继而影响营养状况;溶媒本身是否有潜在毒性。
经口灌胃时,以大鼠为例,水溶性液体的灌胃体积一般不超过10 mL/kg体重,最大不超过20 mL/kg体重;油溶性液体的灌胃体积不超过4 mL/kg体重。
经饲料或饮水给予时,应充分考虑溶媒添加量和动物热量的摄入。若使用溶媒,那么对照组应按受试物组的最高使用量添加;若不使用溶媒,且受试物会造成摄食量或食物利用率的降低,那么可以通过将其饲喂未交配动物作为配对对照组,但是,如有资料表明食物消耗的降低并不影响生殖相关参数,可以不设置配对对照。
经皮给予受试物时,应考虑受试物浓度对皮肤的刺激性。若在既定剂量下的浓度产生较为严重的皮肤刺激性,应将浓度适当降低。当然,这种降低可能也伴随剂量的降低。如果因浓度过高,在早期就出现皮肤严重受损的情况下,应终止试验并选择合适的浓度重新开始。受试物皮肤暴露面积应达到动物全身皮肤的10%,毒性过高的受试物也可以小于10%。可以采用纱布和无刺激性胶带将受试物固定在皮肤表面,需要保证每天6小时的接触时长,同时也可以采用非保定方式防止动物摄入受试物或弄掉封闭胶带。
经吸入给予受试物时,一般采用气体、蒸汽、气溶胶或以上混合形态进行受试物暴露。吸入受试物所采用的暴露物态应根据其理化性质、拟定浓度和/或其实际应用时的物态加以确定。不论采用头鼻暴露还是全身暴露,均需将气流中的氧气浓度控制在至少19%,二氧化碳浓度控制在不高于1%,同时确保受试物浓度稳定。
实验动物和饲养环境
6.1 实验动物选择
首选种属为大鼠,若选择其它种属动物应有合理理由,同时应避免选择生育力低且具有明显发育缺陷的动物种属。所选动物应健康且未经历任何试验,其中雌性动物应为未经产或未孕动物。受试物处理前,动物体重应控制在同性别平均体重的20%范围内,若有必要还应基于发情周期筛选动物,将发情周期正常的雌性纳入试验。动物开始交配的周龄在12-14周龄较为合适。
6.2 动物数量
应保证每组至少有20只怀孕雌性动物,在极端情况下,未能产生足够的怀孕动物时,不表明研究数据无效,需个案分析。雄性动物数量推荐与雌性动物保持一致。
6.3 动物的准备和饲养
动物抵达实验设施后,应有不少于5天的环境适应期。饲养环境应符合国标相关要求。动物自由采食和饮水,但应注意饮食中植物雌激素的含量,避免影响某些生殖终点。所用批次饲料留样并适当保存至报告完成,以便在某些情况下进行回溯分析。
动物交配前可以多只动物饲养于一笼,雌性动物交配成功后(检查到阴栓或阴道涂片阳性)应单笼饲养于含垫料的笼具内,其所产F1代同笼饲养至离乳。离乳后的F1代应按组别、性别分笼饲养,如有合理理由亦可单笼饲养。
暴露途径的选择
推荐采用经口方式(包括饲料、饮水和灌胃),除非其它暴露途径(经皮或吸入)更为合适。
剂量和分组
8.1 常规剂量设计
通常情况下,设置3个剂量组和1个溶媒对照组。在有毒代动力学(Toxicokinetics, TK)数据的情况下,若受试物具有剂量依赖性饱和特征且人的暴露量远低于此,那么所选高剂量应避免出现饱和,比较合适的高剂量应为向非线性转变的拐点。在缺乏TK数据支持的情况下,剂量水平的选择应基于受试物的毒性,如高剂量应产生一定程度的全身毒性,但不致死或造成动物严重的痛苦。通常高剂量组亲代死亡率低于10%可以接受。
在高剂量以下按等比关系设置中低剂量,低剂量应能够确定NOAEL或可以用于推导基准剂量(Bench mark dose, BMD)。通常2-4倍的剂量间距较为合适,不宜采用过大的间距,如拟设间距超过10,则应采用增加剂量组的方法以降低间距。若通过饲料给予受试物,则剂量间距不应超过3倍。
若有溶媒对照,溶媒对照应采用受试物处理组用到的最大体积作为本组动物的给予体积。
8.2 限制剂量试验
当人的可能暴露水平低于1000 mg/kg时,可以考虑进行限度试验。在重复剂量毒性试验中低于1000 mg/kg的情况下无毒性表征,或者无结构或代谢类似物的相关资料,那么仅设计1000 mg/kg的单剂量水平已足够。若在此剂量水平观察到生殖发育毒性,则需要在更低剂量水平确定NOAEL。
试验内容
9.1 试验步骤
F0大鼠从5到9周龄开始连续给予受试物。雌性通常持续暴露至F1代离乳,雄性在不需进行其它生殖效应评价后可以人道处死,但是,所有F0代动物均应保证交配前共计10周,交配期共计2周的受试物暴露期。(流程见附图)
F1离乳时,从每窝选择一雌一雄用于交配,自离乳开始每日给予受试物,若暴露途径为饮水或食物,则其实际暴露可能始于哺乳期。交配期前连续暴露至少10周,并在交配期仍持续暴露2周,一直持续至F2代离乳(流程见附图)。不用于交配的F1和所有F2均于离乳时人道处死,并从每窝分别选取一雌一雄用于大体解剖观察。
9.2 交配
同剂量组的雌雄大鼠按1:1进行交配,交配最多持续2周。通过在早晨检查阴栓或阴道涂片来确定交配成功与否,一旦确定交配成功的雌性应单独饲养,并把发现交配成功的当天定为妊娠第0天(G0)。如若交配不成功,应选择同组已成功交配的其它雄性继续交配,配对信息应准确记录。
在离乳动物中,从每窝选取至少一雌一雄在性成熟后进行交配且交配应在同组不同窝间开展。F1的选取应遵循随机原则,但体重不应低于每窝平均体重两个标准差。
通常情况下不推荐进行二次交配,因为二次交配将不得不失去着床信息。但是,如出现受试物相关的窝产仔数变化或第一次交配中观察到可疑的结果,仍建议F0或F1再次交配。同时,也建议将未成功怀孕的雌性动物与能正常生育的雄性进行二次交配,以确证雌性生育力。二次交配的时间应选在最后一胎离乳后大约一周左右。
9.3 窝的标准化
在出生后第4天,通过随机选择调整窝的大小,尽可能达到每窝每性别5只,若难以达到,做部分调整也可接受(例如:4只雌性和6只雄性)。窝的标准化不宜以体重及肛殖距(AGD)为依据。
9.4 临床观察
每天应进行一般临床观察,在灌胃给药的情况下,其观察时间点应考虑到给药后预期的效果高峰时期。观察并记录行为改变、难产或长时间分娩以及所有毒性症状。更详细的临床观察至少每周一次,可以在给动物称重时进行。每天两次笼旁观察,观察内容包括严重的毒性反应、发病率和死亡率。
每天应进行一般临床观察,在灌胃给药的情况下,其观察时间点应考虑到给药后预期的效果高峰时期,观察F1和F2是否有行为改变,是否有外观异常,是否出现毒性症状。此外,F1还应观察是否难产或长时间分娩。更详细的临床观察至少每周一次,可以在给动物称重时进行。每天两次笼旁观察,观察内容包括严重的毒性反应、发病率和死亡率。
在分娩后(LD0)应尽快检查每窝幼崽,以确定幼崽的数量和性别、存活与否以及是否存在明显外观异常。在第0天发现死亡的幼仔,如果不是浸软胎,建议检查可能存在缺陷和/或死亡原因,并将其保存。子代的其它额外的发育信息,如睁眼,耳廓分离,萌牙,出毛的发生时间可以结合性成熟数据分析,如阴道口张开及包皮龟头分离时的日龄和体重。如果没有单独的功能观察组合试验,那么在F1(非交配用)离乳前后可以观察运动能力,感觉功能,个体反射(出现明显的发育异常时可以不开展功能观察组合试验)。若F1的性别比或性成熟时间出现受试物相关改变后,则需在PND0测量F2的肛殖距。
9.5 体重、摄食及饮水
亲代动物(P和F1)受试物处理第一天应称体重,此后至少每周称一次。其中,雌性应在妊娠第0天、第7天、第14天和第20天(或第21天),以及解剖当天称重,哺乳期与幼仔同一天称量,但哺乳期第4天可以不称重。
子代在哺乳期第0天、第4天、第7天、第14天和第21天及解剖当天称重。
交配前和妊娠期间,每周至少测量一次食物消耗量。如果受试物经饮水给予,则至少每周测量一次饮水。
9.6 动情周期
交配前和交配期间通过阴道涂片进行雌性动情周期的评估,直到确认交配成功。在制作阴道涂片时,应注意避免过度刺激粘膜从而诱导假孕。
9.7 精子参数
解剖时,称重睾丸和附睾,至少保留一侧用于组织病理学检查。每组至少10只雄性的睾丸和附睾分别用于超声匀浆耐受精子细胞头部计数和附睾尾精子计数。用于精子计数的附睾,还可以用于评估精子活力和精子形态,也可另外从输精管采集精子用于以上分析。其中,用于精子形态分析的样本可以是湿样本,也可以是固定样本。精子形态分析应至少观察200个精子,异常精子形态包括头部融合、断头、头部异形、尾部异形。
若拟分析精子样本来自于解剖时及时冻存的样本或固定后的涂片,抑或直接采用精子分析仪等计算机辅助系统及时采集样本图像分析,那么精子参数的分析可仅限于高剂量组和对照组,在有受试物相关性时需扩展至更低的剂量组。
9.8 解剖与病理
F0在解剖当日早上完成体重测量后,制作雌鼠阴道涂片以确定动情周期,便于结合卵巢的组织病理结果分析。解剖时大体观察所有组织脏器,尤其应重点关注生殖系统,并记录所有大体观察异常情况和子宫着床痕数量。以下脏器在完成肉眼观察后应称重,成对的脏器需单独称重。
子宫、卵巢;
睾丸、附睾(整体和尾部);
前列腺;
精囊腺、凝固腺及其分泌物(整体称重);
脑、肝、肾、脾、垂体、甲状腺和肾上腺及已知靶器官。
所保存的脏器中,需要开展组织病理检查的脏器包括:
阴道、子宫(含宫颈)、卵巢;
睾丸、附睾、前列腺、精囊腺、凝固腺;
已明确的的靶器官;
通常先在对照组和高剂量组开展组织病理检查,若发现受试物相关改变可继续检查其它剂量组。此外,疑似生育力降低的情况(未交配成功、未孕、未正常分娩、产生非健康后代、动情周期异常、精子参数改变等)需要对生殖系统进行组织病理检查,大体解剖肉眼观察异常的组织脏器也应进行组织病理检查。
睾丸的组织病理检查建议关注是否有精子潴留,上皮形态及细胞层数是否改变,是否有多核巨细胞的形成,管腔内是否有脱落上皮。附睾的检查应包含完整的头、体、尾纵切面。建议关注是否有白细胞浸润,管腔内是否有异常形态的精子细胞,是否发生巨噬细胞的吞噬现象。
卵巢的组织病理检查则主要采用定量的方法以检测原始卵泡是否减少,也可以结合初级卵泡进行比较。定量分析时,应保证每组至少10只动物,同时还要考虑连续切片抽取间距及切片厚度等因素。
需要解剖并大体观察的子代包括:
F2离乳时从每窝随机挑选的一雌一雄及其亲代F1;
F1离乳时从每窝随机挑选的非交配用一雌一雄;
所有临床观察异常或外观异常的子代;
濒死状态人道处死的幼仔;
死产幼仔(非浸软胎)。
其中,在濒死状态人道处死的幼仔和死亡幼仔,应检查可能的缺陷和/或死亡原因,并保存。初产雌性子宫应在计数着床痕后固定保存。
需要称重的组织脏器包括:
交配用F1子宫、卵巢;
交配用F1睾丸、附睾(整体和尾部);
交配用F1前列腺;
交配用F1精囊腺、凝固腺及其分泌物(整体称重);
交配用F1脑、肝、肾、脾、垂体、甲状腺和肾上腺及已知靶器官。
此外,离乳时从F1和F2随机选取用于大体解剖观察的一雌一雄仅需称重脑、胸腺和脾脏。
需要做组织病理的子代动物有:
大体解剖观察到异常的动物;
临床观察出现毒性反应的动物;
离乳时每窝随机选取的一雌一雄F1和F2
外观异常的动物;
交配用F1;
需要做组织病理检查的组织脏器包括:
阴道、子宫(含宫颈)、卵巢;
睾丸、附睾、前列腺、精囊腺、凝固腺;
大体解剖观察到异常的组织脏器;
已明确的靶器官。
通常先在对照组和高剂量组开展组织病理检查,若发现受试物相关改变可继续检查其它剂量组。此外,疑似生育力降低的情况(未交配成功、未孕、未正常分娩、产生非健康后代、动情周期异常、精子参数改变等)需要对生殖系统进行组织病理检查,大体解剖肉眼观察异常的组织脏器也应进行组织病理检查。
睾丸的组织病理检查建议关注是否有精子潴留,上皮形态及细胞层数是否改变,是否有多核巨细胞的形成,管腔内是否有脱落上皮。附睾的检查应包含完整的头、体、尾纵切面。建议关注是否有白细胞浸润,管腔内是否有异常形态的精子细胞,是否发生巨噬细胞的吞噬现象。
卵巢的组织病理检查主要关注原始卵泡是否减少,并计数原始卵泡数量,计数必须紧密结合切面的数量、切面间距及受检动物总数。
数据处理、统计方法及结果评定
数据以报告附件的形式用表格汇总。报告中应包含以下内容:
试验开始时的动物数量;
试验中发现死亡或因人道原因被杀的动物数量、时间;
可生育的动物数量;
怀孕的雌性动物数量;
分娩雌性动物数量;
出现毒性反应动物数量;
毒性反应的描症状、发病时间、持续时间和严重程度。
数据应采用合适的、可接受的统计方法进行评估。应适当处理非正态数据(如计数数据)、截尾数据(如有限的观察时间)、非独立性数据(如窝效应和重复测量)和不等方差。报告中应包含具体的统计分析方法和用于统计分析的软件信息。
根据试验中观察到的结果(包括大体观察结果和显微镜检查结果)评价受试物的生殖发育毒性效应。包括是否存在剂量相关的异常、病变发生率和严重程度变化。此外,还包括靶器官、生育力、临床异常、生殖和产仔性能、体重变化、死亡率以及其他任何毒性和发育影响。需特别注意性别特异性变化。为了准确评价受试物的影响,也可以结合受试物的理化性质,以及TK数据(包括胎盘透过和乳汁排泄)进行分析。
设计合理的生殖毒性试验应能估计NOAEL剂量水平,并对受试物在生殖、分娩、哺乳及出生后发育(包括生长和性发育)的不利影响尽可能充分暴露。
结果解释
两代生殖发育毒性研究资料可以提供受试物在生殖周期所有阶段重复暴露的影响。尤其是提供了有关生殖功能及生育力相关参数以及关于后代生长发育和存活情况的信息。该研究的结果应结合亚慢性毒性、产前发育、毒性动力学以及其他现有研究的结果来解释。其结果有助于评估是否有必要将受试物推进到下一个研究节点。同时,该结果在一定程度上外推至人是有效的,可以用于提供NOAEL及人体暴露风险信息。
附图
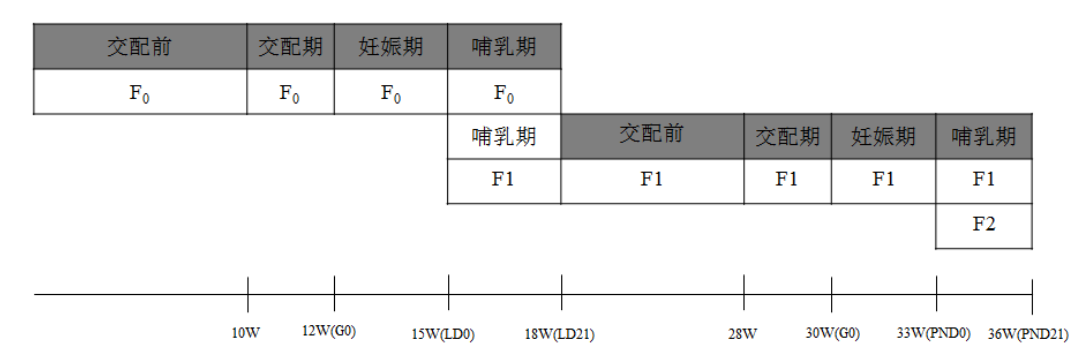
受试物暴露期 |
图1. 两代生殖发育毒性试验流程图
两代生殖发育毒性试验
起草说明
为加强化妆品的监督管理,进一步提高化妆品使用安全性,中国食品药品检定研究院组织开展了《化妆品生殖发育毒性试验指导原则》方法的研究制定工作。现就工作有关情况说明如下:
1. 起草原则
本指导原则旨在通过合理的实验设计评估化妆品原料的生殖发育毒性。化妆品原料对人的暴露特征为低剂量长期暴露,在设计实验时应考虑该暴露特征,尽可能充分评估生殖发育毒性各试验终点并将各终点的关联性统一在模型中反应出来。基于此,单一全程设计适合用于化妆品生殖发育毒性评估。
2. 起草过程
在本次起草过程中,我们了解了各国(地区)化学品及化妆品原料监管方式,以及安全性评价相关资料的提交要求。我们也学习了各种生殖发育毒性试验方法的应用范围,优点和缺陷。在此基础上,结合我国的化妆品原料监管特征,选择了合适的生殖发育毒性研究方法,形成了目前的《化妆品生殖发育毒性试验指导原则》。
3. 与我国已有相关标准的关系
目前,我国化学品、食品、兽药、农药及医疗器械均参考了OECD系列生殖发育毒性试验指导原则,但各个领域适用情况参差不齐。其中,农药采用两代繁殖毒性试验,兽药采用传统繁殖毒性试验,尚未见扩展一代生殖发育毒性试验。化学品的注册管理方式遵循OECD要求采用分级注册,具体涉及筛选试验、两代生殖发育毒性,并在《常规申报毒理学最低数据要求》中明确可用扩展一代生殖发育毒性试验替代两代生殖发育毒性试验。医疗器械领域则直接引用OECD421、OECD 414、OECD415、OECD416。食品则在保留传统繁殖毒性试验的基础上增加了扩展一代生殖毒性试验和两代生殖毒性试验,略显繁杂。
由此可见,两代生殖发育毒性试验仍然被作为各个领域生殖发育毒性试验的主流试验方法。将其用于全面评估化妆品原料的生殖发育毒性具有合理性。
4. 与《规范》中原方法的对比情况
《规范》中尚无该方法相关内容,该部分属于新增内容。
5. 国际相关标准情况
国际上关于生殖发育毒性的研究方法包括药品常用的三段生殖发育毒性研究方法和化学品领域常用的N代生殖发育毒性研究方法。
三段生殖毒性试验方法由FDA于1966针对沙利度胺事件推出,而后经ICH进一步发展已成为世界范围普遍接受用于药品生殖发育毒性研究的方法,但囿于其有限的暴露周期仅适用于关注特定方面的生殖发育终点,例如子代生殖系统的发育毒性就无法被覆盖。
对化学品的生殖发育评估方法最初也是借鉴FDA对药品的试验设计,但其暴露周期过短,试验终点评估不足,因此后来将其暴露周期延长至子代,并根据其研究代数不同,分为一代生殖发育毒性试验方法和两代生殖发育毒性试验方法。1988年EPA工作组在一代生殖发育毒性试验和两代生殖发育毒性试验比较会议上得出结论,认为一代生殖发育毒性试验无法评估潜在生殖发育毒物,仅能获得有限的生殖发育毒性信息。在此后很长一段时间,两代生殖发育毒性试验成为了评估化学品生殖发育毒性的金标准。但是,其缺点也较为明显,比如耗费动物数量巨大、试验周期长、研究工作繁重。尽管如此,该方法仍然作为生殖发育毒性研究的主流方法之一。
目前,欧盟消费者安全科学委员会(Scientific Committee on Consumer Safety, SCCS)、日本化妆品学会(Japanese Cosmetic Science Society, JCSS)及美国个人护理产品委员会(Personal Care Products Council, PCPC)关于化妆品生殖发育毒性研究方法均推荐OECD系列试验方法,但日本化妆品学会还推荐了ICH试验方法。由此也可以看出化学品生殖发育毒性试验方法的适用并不完全统一。
OECD系列生殖发育毒性试验主要包括如下几个研究方法:筛选试验(OECD TG 421);一代生殖发育毒性试验(OECD TG415);两代生殖发育毒性试验(OECD TG 443);扩展一代生殖发育毒性试验(OECD TG416)。
其中,筛选试验属于筛选信息数据集的组成部分,是OECD对成员国注册高产量化学品安全性评估资料的要求。一代生殖发育毒性试验因其局限性而较少被推荐采用。两代生殖发育毒性试验虽能较为全面的评估生殖发育毒性,但是大量的实验动物耗费面临巨大的动物福利压力。扩展的一代生殖发育毒性试验虽然具有一些优势,但其部分内容尚待完善,且各监管机构对于其替代两代生殖发育毒性试验方法的态度尚不明朗。
6. 实验室验证情况
本指导原则属研究性质非检测类,不涉及实验室验证。
7. 其它需说明问题
无。


